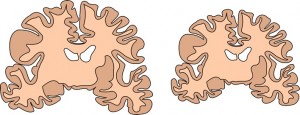
Ist die Gehirnentwicklung gestört, führt dies unter anderem zu einem krankhaft verkleinerten Kopf. Oder umgekehrt: Wenn Kinder mit dieser als Mikrozephalie bezeichneten Störung (dies betrifft eines von 10.000 Kindern) zur Welt kommen, liegt die Ursache in einer fehlerhaften Entwicklung des Gehirns. Die Betroffenen sind geistig schwer beeinträchtigt und ihre Lebenserwartung ist deutlich verringert. Auch bestimmte Fälle von Autismus und Schizophrenie werden mit der Regulation der Gehirngröße in Verbindung gebracht.
Neurobiologen am Wiener Forschungsinstitut für Molekulare Pathologie (IMP) haben nun eines der Schlüssel-Gene für die menschliche Gehirnentwicklung identifiziert. Mutationen dieses Gens führen zu schweren Entwicklungsstörungen. Einige bekannte Krankheitsbilder könnten damit erklärt werden. Die Arbeit “Mutations in the beta-tubulin Gene TUBB5 Cause Microcephaly with Structural Brain Abnormalities” erschien am 13. Dezember 2012 im Online-Journal “Cell Reports”.
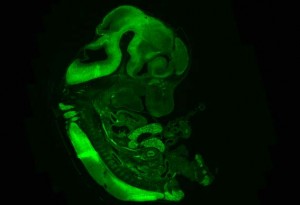
Der australische Biologe David Keays, der am IMP eine Forschungsgruppe leitet, hat gemeinsam mit seinem Doktoranden Martin Breuss ein für Mikrozephalie verantwortliches Gen namens TUBB5 identifiziert. Es gehört einer Familie von Genen an, die Varianten des Proteins Tubulin produzieren. Aus Tubulin baut die Zelle ihr inneres Skelett auf, das sowohl bei Bewegungen als auch bei der Teilung von Zellen eine wichtige Rolle spielt.
In Zusammenarbeit mit Wissenschaftlern der Monash-Universität (Australien) konnten die IMP-Forscher im Gehirn ungeborener Mäuse gezielt die Funktion von TUBB5 stören. Dies führte zu Veränderungen im Stammzellen-Pool und beeinträchtigte die Wanderung der Nervenzellen. Beides – der ungehinderte Nachschub von Neuronen aus dem Stammzell-Reservoir und ihre korrekte Positionierung am Bestimmungsort in der Hirnrinde – sind wichtige Voraussetzungen für die Gehirnentwicklung.
Diese Vorgänge sind auch aus einem evolutionären Blickwinkel interessant. Die Anzahl der Nervenzellen relativ zum Körpergewicht und ihre Anordnung in einem stark gefalteten Großhirn korrelieren mit der Entwicklung von niederen Affen zu Primaten und schließlich zum Menschen. Gene, die entweder die Zahl oder die Wanderung der Neuronen beeinflussen, erlauben deshalb oft Rückschlüsse auf die genetischen Grundlagen dieser Evolution.
Um zu überprüfen, ob die an Mäusen gewonnenen Erkenntnisse auch auf den Menschen anwendbar sind, arbeitet David Keays mit Klinikern der Pariser Sorbonne zusammen. Das französische Team unter Jamel Chelly untersuchte 120 Patienten, deren Gehirnstruktur krankhaft verändert war und die unter starken Behinderungen litten. Bei drei betroffenen Kindern fanden sie ein mutiertes TUBB5-Gen. Für David Keays ist die Aufklärung der Funktion von TUBB5 eine wichtiger Schlüssel zum Verständnis der Gehirnentwicklung. Und er fügt hinzu: “Unsere Arbeit ist ein gutes Beispiel dafür, wie sich Erkenntnisse aus der Grundlagenforschung an Tiermodellen auf die Humanmedizin übertragen lassen.”
Für die Mediziner ist ein solch ursächlicher Zusammenhang eine wertvolle Information. Sie können Eltern von schwer entwicklungsgestörten Kindern genetisch beraten und ihnen unter Umständen die Angst vor weiteren Schwangerschaften nehmen. Langfristig ist damit auch die Hoffnung verknüpft, eines Tages mit
gezielten Therapien helfen zu können. Die Ursachen des verminderten Gehirnwachstums können -neben einem Gendeekt- umweltbedingter Stress (zum Beispiel Alkoholmissbrauch, erhöhte radioaktive Strahlung) aber auch virale Infektionen (etwa eine Rötelnerkrankung in der Schwangerschaft) sein.
Das Forschungsinstitut für Molekulare Pathologie betreibt in Wien biomedizinische Grundlagenforschung und wird dabei maßgeblich von Boehringer Ingelheim unterstützt. Mehr als 200 ForscherInnen aus über 30 Nationen widmen sich der Aufklärung grundlegender molekularer unellulärer Vorgänge, um komplexe biologische Phänomene im Detail zu verstehen und Krankheitsmechanismen zu entschlüsseln.